Por Jair Calixto*
Vários requisitos novos foram introduzidos na RDC nº 301/2019. Em artigos anteriores abordei Capítulo II – Sistema da Qualidade Farmacêutica e Capítulo IV – Instalações e Equipamentos. Hoje vou abordar o Capítulo V – Documentação.
Avaliando este capítulo, vemos que a seção introdutória traz uma informação que para mim é relevante; diz que os vários tipos de documentos e mídias utilizados devem ser totalmente definidos no Sistema de Gestão da Qualidade e que esta documentação pode ser em mídia impressa, eletrônica ou fotográfica. Isto quer dizer que, definitivamente, as mídias eletrônicas podem ser usadas e da forma que a empresa pretender, desde que obedeçam aos princípios e requisitos estabelecidos nas BPFs. Paperless e documentação eletrônica são, com certeza, estímulos para as empresas neste artigo.
Há um artigo que fala sobre “controles adequados para garantir a precisão, integridade, disponibilidade e legibilidade dos documentos”. Isto é conhecimento básico de BPF, conhecido por todos os profissionais da indústria farmacêutica e disposto nos primórdios das BPFs. Mas a novidade aqui é o uso do termo integridade. O Guia FDA sobre este tema, chamado Data Integrity and Compliance With CGMP Guidance for Industry, de abril de 2016, define a integridade de dados como ALCOA*:

*atualmente está sendo chamado de ALCOA Plus ou ALCOA+, com a inclusão de completo, consistente,
duradouro e disponível.
Esta nova roupagem, em virtude também, da ampliação do uso da TI e TA nas indústrias, deu uma característica mais técnica ao registro de documentos, tratando-o como um novo item, com conteúdo expandido. Destaco então, este relevante tema neste capítulo V, pois falhas na integridade de dados levam a não conformidades nas inspeções pelos órgãos reguladores.
Na seção III o tema é abordado também, onde os registros manuais devem ser feitos de modo claro, legível e indelével. Conforme relatório da ANVISA, apresentado ao setor anteriormente, dentre as 10 maiores não conformidades nas inspeções de BPFs, está o não cumprimento da integridade de dados em determinadas situações verificadas, como registro de laudo analítico, preenchimento de ordem de produção, entre outras.
A seção VI, sobre fórmula de fabricação e instruções de processo menciona a reconciliação, importante instrumento de checagem de eventuais desvios de qualidade, sendo que, caso sejam utilizados controles eletrônicos robustos durante a embalagem, pode haver justificativa para não incluir essa informação. Então aqui surge uma novidade, beneficiando quem investiu em automação.
A Seção VII diz que deve haver políticas, procedimentos, protocolos, relatórios e registros para as todas as atividades, quando das ações tomadas ou conclusões alcançadas. Alguns exemplos foram citados:
I – validação e qualificação de processos, equipamentos e sistemas;
II – montagem e calibração de equipamentos;
III – transferência de tecnologia;
IV – manutenção, limpeza e sanitização;
V – questões de pessoal, incluindo listas de assinaturas, treinamento em Boas Práticas de
Fabricação e temas técnicos, vestuário e higiene e verificação da efetividade do treinamento;
VI – monitoramento ambiental; VII – controle de pragas;
VIII – reclamações; IX – recolhimento; X – devoluções; XI – controle de mudança;
XII – investigações sobre desvios e não conformidades;
XIII – auditorias internas de qualidade / Boas Práticas de Fabricação;
XIV – resumos de registros, quando apropriado (p.ex., revisão da qualidade do produto);
XV – auditorias em fornecedores.
Nada novo aqui, a não ser o fato de indicar os benefícios para a melhoria contínua. Se todas as ações e avaliações realizadas nestes processos forem completamente analisadas, registradas e concluídas, o trabalho de organização de dados para o relatório da RPP – Revisão Periódica do Produto ou Revisão Periódica de Qualidade, estará facilitado. Além disso, todos estes processos são fonte de melhoria contínua e, quando devidamente considerados, aumentarão o nível de qualidade dos produtos e dos processos.
A seguir, um gráfico com o resumo dos principais apontamentos deste Capítulo, e com as possíveis aplicações dos mesmos, segundo meu entendimento.
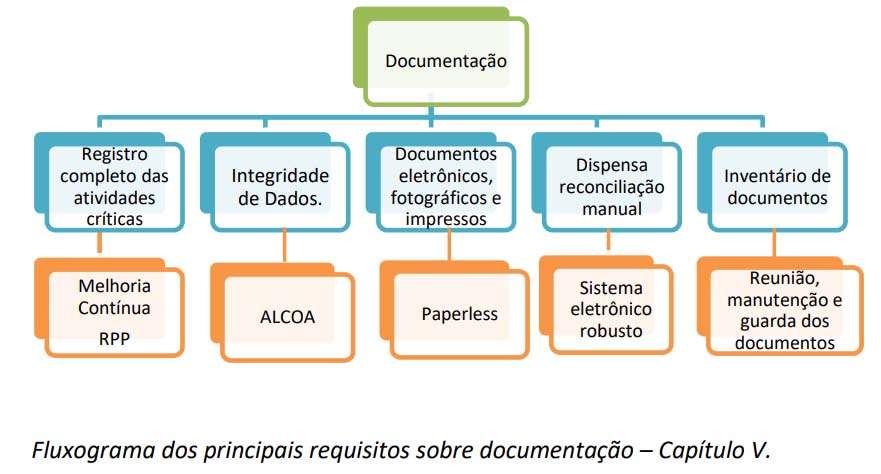
Para finalizar, neste capítulo é utilizado um termo novo para relacionar todos os documentos do Sistema de Gestão da Qualidade, o inventário. Esta palavra descreve melhor (prevê informações completas) a reunião, a manutenção e a guarda de todos os documentos da empresa, relacionados ao sistema da Qualidade.
Era isso por hoje. Um abraço a todos e até a próxima avaliação, do Capítulo VI – Produção.
Jair Calixto é especialista em Boas Práticas de Fabricação do IBBPF. Visite o Canal BPF no YouTube e o Instagram.
 2A+ Farma Portal de notícias
2A+ Farma Portal de notícias
