Convidecia Air™ é a primeira vacina nasal para Covid-19 é aprovada no mundo
Leia Mais »Resultados da pesquisa para: covid
No mundo todo, infecções fúngicas aumentaram a mortalidade de internados por COVID-19
André Julião | Agência FAPESP – Todos os dias inalamos milhares de esporos de fungos potencialmente patogênicos, mas nosso sistema imune simplesmente os elimina. Em pessoas que estão com a imunidade comprometida – como transplantados, pacientes em tratamento contra o câncer ou internados em Unidades de Terapia Intensiva (UTIs) –, porém, essa interação entre patógeno e hospedeiro pode ser bastante diferente.
Leia Mais »Advanced biologic drugs and COVID-19 vaccines creating opportunities for packaging providers to supply big pharma companies, says GlobalData
Injectable drugs and their packaging requirements are providing ample opportunities for packaging firms to supply big pharmaceutical companies, given the volume of vaccines, including the latest Omicron boosters required to tackle the COVID-19 pandemic, and the rising number of biologics, says GlobalData, a leading data and analytics company.
GlobalData’s report, ‘Contract Injectable Packaging Trends in the Bio/Pharma Industry’, reveals that there was an increase in approvals of injectable drugs from 2020 to 2021. The FDA and EMA generally approve more injectable drugs developed by large (market cap $10–100 billion) and mega cap (market cap >$100 billion) pharma companies than by smaller companies with market caps below $10 billion. Non-injectable approvals tend to have more small and mid cap sponsors as a proportion. This is because injectables – such as vaccines and monoclonal antibodies – are more complex than oral solid dose drugs – such as tablets – and so tend to be developed by larger companies with deeper pockets.
Adam Bradbury, Pharma Analyst at GlobalData, comments: “For injectable drugs, the FDA’s New Drug Application (NDA) approvals were relatively high in 2021 for small cap and mega cap drug sponsors. The number of approved injectable drugs sponsored by small, large, and mega cap companies increased since 2020.”
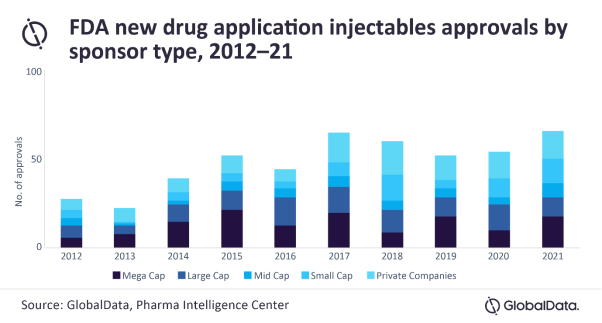
Bradbury continues: “The trend of small cap approvals increasing is potentially advantageous to contract manufacturing organisations (CMOs), given that historically their clients are more likely to be smaller companies that are unable to invest in their own facilities or enhance their own capabilities.”
The outsourcing propensity (the percentage of approved drugs for which a pharma sponsor company outsources manufacturing) is influenced greatly by the sponsor’s market cap and ability to acquire capabilities to package rather than outsourcing the task to a contractor. Innovative injectable products are more frequently sponsored by large and mega cap pharma companies than non-injectable or generic approvals.
Bradbury concludes: “Certain innovative products like cell and gene therapies have a limited pool of staff and expertise that can engage with their production; large CMOs have been acquiring these capabilities in recent years and, again, large and mega cap sponsors will require these services.”
Pesquisadores da USP validam a eficácia de três novos testes sorológicos para a COVID-19
Agência FAPESP* – Pesquisadores do Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP) atestaram a eficácia de três novos testes sorológicos para a COVID-19. Desenvolvidos no próprio ICB, os testes usam o método ELISA (ensaio de imunoabsorção enzimática) para a detecção dos anticorpos contra o vírus SARS-CoV-2 e tiveram sua eficácia comparada com outro teste já em uso no mercado, o Elecsys, da farmacêutica Roche.
Leia Mais »Estudo relaciona alteração de olfato ou paladar após a COVID-19 com problemas de memória
Karina Toledo | Agência FAPESP – Estudos feitos antes da pandemia de COVID-19 apontaram a perda de olfato como um possível sinal precoce da doença de Alzheimer. Há, na literatura científica, evidências de que essa disfunção sensorial pode se manifestar anos antes dos primeiros sintomas cognitivos aparecerem, o que sugere haver uma conexão entre a região cerebral responsável pela memória e a que registra e interpreta os estímulos olfativos.
Leia Mais »Covid-19 acelerou a participação de empresas brasileiras na corrida da pesquisa clínica mundial
Abracro (Associação Brasileira de Organizações Representativas de Pesquisa Clínica) é grande facilitadora dos processos burocráticos que envolvem a aprovação e divulgação das pesquisas realizadas no país
Leia Mais »Conjunto de moléculas alteradas no sangue de pacientes com COVID-19 pode indicar risco de complicações
Agência FAPESP* – Estudar o plasma sanguíneo de pessoas diagnosticadas com a COVID-19 em busca de biomarcadores que indiquem o risco de o paciente desenvolver a forma grave da doença tem sido o objetivo de pesquisadores em todo o mundo. Um trabalho nessa linha foi recentemente divulgado por um grupo da Universidade de São Paulo (USP) no Journal of Proteome Research.
Leia Mais »Positividade em testes de covid-19 no primeiro semestre de 2022 é maior que no mesmo período de 2021, segundo Abramed
Foram 38,1% de positividade em 2022 contra 15,6% em 2021, apesar de ter sido realizado o dobro de exames
Leia Mais »Moderna recebe autorização do FDA para uso emergencial da vacina contra Covid-19 para crianças de seis meses ou mais
Vacina mRNA1273 foi autorizada para crianças a partir de seis meses administradas em duas doses com intervalo de um mês; No Brasil, a empresa é representada pela Zodiac Produtos Farmacêuticos
São Paulo, junho de 2022 — A Moderna, uma empresa de biotecnologia pioneira em terapêutica e vacinas de RNA (mRNA) para mensageiros, anunciou hoje que recebeu autorização de uso emergencial (EUA) da U.S. Food and Drug Administration (FDA) para sua vacina contra Covid-19 (mRNA-1273) em crianças pequenas de 6 meses a 5 anos de idade em uma dose de 25 µg. A empresa também recebeu autorização de uso emergencial para um regime de 50 μg duas doses de mRNA-1273 para crianças de 6 a 11 anos de idade e um regime de 100 μg duas doses para adolescentes de 12 a 17 anos de idade. Os regimes de duas doses, com doses adaptadas para cada faixa etária, com um mês de intervalo, são bem oportunos para iniciar a proteção para o início do ano letivo, à medida que as crianças retornam às salas de aula e creches de maior risco.
“Estamos entusiasmados que a FDA tenha concedido a autorização de uso emergencial da vacina contra COVID-19 da Moderna para crianças e adolescentes, particularmente para nossas crianças mais jovens e vulneráveis”, disse Stéphane Bancel, Diretor Executivo de Moderna. “As crianças precisam viver vidas altamente sociais para se desenvolverem e florescerem”. Com esta autorização, os cuidadores de crianças pequenas de 6 meses a 5 anos de idade finalmente têm uma maneira de se proteger contra os riscos da Covid em ambientes de sala de aula e creches. Nossa vacina pediátrica contra Covid-19 é um regime de duas doses para todas as crianças de 6 meses ou mais, proporcionando proteção contra a COVID-19 duas semanas após a segunda dose”.
Na América Latina, o grupo Adium fechou um acordo com a Moderna para a distribuição e comercialização d a vacina desenvolvida pela farmacêutica norte-americana contra a Covida-19. No Brasil, a operação será conduzida pela Zodiac Produtos Farmacêuticos, subsidiária do grupo Adium no país.
No âmbito do acordo, a Zodiac irá colaborar com Moderna na gestão dos contratos de fornecimento da vacina, bem como nos processos de registros nas agências reguladoras, apoio às atividades de Farmacovigilância, Educação Médica Continuada, Assuntos Governamentais para garantir acesso e disponibilidade da vacina no Brasil.
No início do mês de abril, a Agência Nacional de Vigilância Sanitária (Anvisa) realizou uma reunião técnica com a Zodiac e a Moderna para tratar da regularização da vacina, que já conta com registro definitivo nos Estados Unidos, com autorização emergencial da Organização Mundial da Saúde, além de ter sido autorizada para uso em outros 84 países.
A mRNA-1273 para crianças e adolescentes mostrou proteção a partir de 14 dias após a segunda dose. A proteção foi estatisticamente significativa, com dados provenientes de ensaios grandes e bem controlados de mais de 14.000 crianças e adolescentes e um acompanhamento mediano de mais de 2 meses para 6 meses até 5 anos de idade, 5,6 meses para 6 até 11 anos de idade, e 11,1 meses para adolescentes.
Os resultados interinos positivos do estudo da Fase 2/3 do KidCOVE, anunciado em 23 de março de 2022, mostraram uma resposta robusta de anticorpos neutralizantes nos 6 meses a 5 anos de idade consistente com adultos jovens, mesmo na dose mais baixa de 25 μg, juntamente com um perfil de segurança favorável consistente com outras faixas etárias. Os títulos de anticorpos nos subgrupos pré-especificados de 6 meses a 23 meses e de 2 anos a 5 anos de idade preencheram os critérios de sucesso para similaridade com os adultos no estudo COVE, o que satisfez o objetivo principal do estudo. O objetivo secundário da eficácia da vacina foi observado como 51% e 37% com base na RT-PCR confirmou a definição de casos COVID-19 e CDC nos grupos de 6 meses a 23 meses e 2 anos a 5 anos, respectivamente, comparável à eficácia da vacina observada em adultos que receberam mRNA-1273 durante o mesmo período predominante Omicron.
A Moderna compartilhou resultados interinos de seu estudo KidCOVE da Fase 2/3 na faixa etária de 6 a 11 anos em outubro de 2021, que mostrou respostas de anticorpos neutralizantes não-inferiores anti-SARS-CoV-2 na dose de 50 μg, quando comparada à dos indivíduos de 18 a 25 anos de idade do estudo COVE da Fase 3. O ponto final secundário da eficácia da vacina nos 6 a 11 anos de idade durante a onda Delta foi observado como sendo de 88% com base na definição do caso CDC. Em maio de 2021, a empresa compartilhou os resultados interinos de seu estudo da Fase 2/3 TeenCOVE do mRNA-1273 na dose de 100 μg. O anti-SARS-CoV-2 neutralizante não-inferior na dose de 100 μg foi demonstrado quando comparado com o estudo COVE da Fase 3 em indivíduos de 18 a 25 anos. A resposta de anticorpos também foi demonstrada como não-inferior para adultos e a eficácia da vacina nos quase 2.500 adolescentes que receberam a vacina Moderna COVID-19 foi observada como sendo de 93% quando se utilizou a definição de caso CDC.
Os ensaios clínicos demonstraram a segurança e tolerabilidade do mRNA-1273 em todas as faixas etárias pediátricas, sem mortes ou casos de miocardite ou pericardite relatados. O sintoma local mais comumente relatado foi a dor no local da injeção em todas as faixas etárias. Os sintomas sistêmicos mais comumente relatados foram dor de cabeça e fadiga em crianças mais velhas e irritabilidade em crianças mais novas.
A vacina COVID-19 da Moderna estará disponível para crianças e adolescentes em locais de vacinação selecionados nos Estados Unidos, nos próximos dias. As crianças vacinadas no início deste verão norte-americano com um regime de duas doses iniciarão a proteção quando retornarem à escola e à creche no outono. Milhões de crianças e adolescentes foram vacinados com segurança com mRNA-1273 em todo o mundo.
Em 31 de janeiro de 2022, o FDA aprovou o pedido de Licença Biológica (BLA) para SPIKEVAX (Vacina contra Covid-19, mRNA) para prevenir a doença em indivíduos de 18 anos de idade ou mais. Anteriormente, a vacina da Moderna estava disponível nos EUA desde de 18 de dezembro de 2020. Uma terceira dose da vacina Moderna na dose de 100 µg também é autorizada para uso de emergência em indivíduos imunocomprometidos 18 anos de idade com certos tipos de imunocomprometimento. Uma dose de reforço de 50 µg é autorizada para uso emergencial nos EUA para adultos com 18 anos de idade ou mais. Uma segunda dose de reforço de 50 µg é autorizada para uso de emergência nos EUA sob os EUA para adultos a partir de 50 anos de idade e indivíduos com mais de 12 anos de idade que estejam moderada ou severamente imunocomprometidos.
A Moderna continua a coletar e monitorar dados do mundo real sobre sua vacina contra Covid-19. As evidências continuam a confirmar a eficácia e o perfil de segurança da vacina da empresa.
Material sintetizado na UFSCar mostra potencial para combater a COVID-19 de diferentes formas
Um material com potencial de eliminar o vírus da COVID-19 em superfícies e, além disso, combater complicações inflamatórias da doença in vivo foi descrito por pesquisadores do Centro de Desenvolvimento de Materiais Funcionais (CDMF) em artigo publicado na revista Scientific Reports. Leia Mais »
 2A+ Farma Portal de notícias
2A+ Farma Portal de notícias
