Por Jair Calixto e Maria José D. Fagundes *
1 – Introdução
O uso de derivados do Cânhamo tem se acentuado no mundo todo e no Brasil. Diversas enfermidades estão sendo tratadas com CBD – Canabidiol (principalmente) e THC – Tetrahidrocanabinol. Em diversos países já existem produtos fora do âmbito farmacêutico, criando um cenário bastante promissor. Por outro lado, ainda que o uso humano de produtos de Cannabis esteja liberado no Brasil, percebe-se um desconhecimento por parte da sociedade em geral.
Este artigo traz um resumo contendo diversas informações sobre o uso, comercialização, produção e qualidade, assim como as normas que regulam o assunto e os Projetos de Lei que buscam liberar plantio e extração.
2 – Histórico
Segundo o respeitado cientista e professor, Dr. Elisaldo Carlini, de uma certa maneira, a história do Brasil está ligada à planta Cannabis sativa L., desde a chegada das primeiras caravelas portuguesas em 1500. As velas e o cordame daquelas embarcações eram feitas de fibra de cânhamo, como também é chamada a planta. Aliás, a palavra maconha em português seria um anagrama da palavra cânhamo¹.
A planta era utilizada na medicina, nas boticas para fabricação de xaropes, *pílulas para dor e para dormir, passando pela indústria automobilística, já que FORD desenvolvia combustíveis a base do óleo de Cannabis. Gutemberg imprimiu as primeiras 135 bíblias em papel de cânhamo, além do uso no setor têxtil, em Pesquisa Clínica e em medicamentos patenteados14, 15.
As mudanças proibitivas foram iniciadas com a Lei Seca nos Estados Unidos, entre 1929/1930. O recém-criado Comitê de Proibição, espalhava que o aumento da criminalidade estava atrelado ao aumento do uso da Cannabis, mas sabe-se, por historiadores que a recessão mundial de 1929 aumentou a criminalidade naquele período.
A divulgação de reportagens sobre a planta, pelo lobby da indústria do petróleo, de tecidos sintéticos e papel concretizaram a criminalização da Cannabis, em 1930, naquele país.
Passados mais de 59 anos, o Comitê Experts em Dependência de Drogas da Organização Mundial de
Saúde, por 6 anos estudou os reais impactos do Canabidiol e recomendou sua exclusão da Lista de Controle. Em dezembro de 2020, a Comissão de Drogas Narcóticas (CDN) da Organização das Nações Unidas (ONU) reclassificou a cannabis, retirando a planta e a resina extraída dela do anexo IV da Convenção sobre Drogas de 1961, reservado aos entorpecentes mais perigosos. Isso significa que a cannabis deixou de estar no grupo onde estão substâncias como a morfina, um opioide amplamente utilizado em medicamentos²
O esforço para a proibição contou com o uso dos veículos de comunicação e a participação de pessoas influentes e poderosas.
3- Cenário legislativo para derivados da Cannabis sativa para fins medicinais
*Pílulas: São formas farmacêuticas muito antigas, hoje pouco produzidas industrialmente. Foram substituídas gradativamente pelos comprimidos.
No Brasil a primeira lei que proibiu o uso da Cannabis foi em 1830, conhecida como a Lei “pito do Pongo”, aplicava pena mais rígida para o usuário – escravos e negros, e não para os traficantes que eram brancos e de classe média.
Ainda hoje é crime plantar, mesmo que pequenas quantidades e a pena é de advertência, prestação de serviço à Comunidade ou medidas educativas.
Até 1976 todas as outras Leis Brasileiras e até o Código Penal de 1940, mantiveram por cerca de 176 anos a proibição total no Brasil. Desde a proibição em 1930, foi a Lei 6368/76 que iniciou a abertura para a regulamentação.
Com relação à legislação brasileira e internacional sobre o uso e tráfico de drogas e entorpecentes, em 1988, foi publicada a “Convenção das Nações Unidas contra o Tráfico Ilícito de Entorpecentes e Substâncias Psicotrópicas de 1988”, que estabeleceu medidas abrangentes contra o tráfico ilícito de drogas.
A repressão ao uso e comercialização de substâncias entorpecentes se intensificou em 2006 com a vigência da Lei nº 11.343/06 (Lei de Drogas), a qual, em seus artigos 1º e 66, enquadra as substâncias constantes do Anexo I da Portaria SVS/MS nº 344/98 como definidoras das “drogas”, objeto da proibição pela Lei de 2006, na qual se encontra a cannabis sativa. O parágrafo 1º do artigo 28 inclui na incidência de crime quem “para quem semeia, cultiva ou colhe plantas destinadas à preparação de substância capaz de causar dependência física ou psíquica”. Mas o parágrafo único do artigo 2º permite o plantio, o cultivo e a colheita para fins medicinais/científicos, dede que autorizado pela União. Em resumo, existe desde 2006 previsão autorizativa para o cultivo e uso de cannabis sativa para fins medicinais.
4- Atos infra legais: Ministério da Saúde/ANVISA/Conselho Federal de Medicina
O Ministério da Saúde no Brasil iniciou o processo de controle no Executivo, estabelecido pelas legislações vigentes, com a Portaria SVS nº 344/199810, regulamento sobre substâncias e produtos sujeitos a controle especial.
A Portaria SVS/MS nº 344/9810 é que aborda os critérios sobre a prescrição e dispensação de medicamentos sujeitos a controle especial.
As listas presentes no Anexo I do referido regulamento, preveem a cannabis sativum na lista de “plantas que podem originar substâncias entorpecentes e/ou psicotrópicas”, bem como o tetraidrocanabinol (THC) na lista de substâncias proibidas no Brasil. As listas foram atualizadas pela RDC nº 734, de 11/7/2022 – ANVISA, publicada em 13 de julho de 2022 e traz as seguintes determinações:
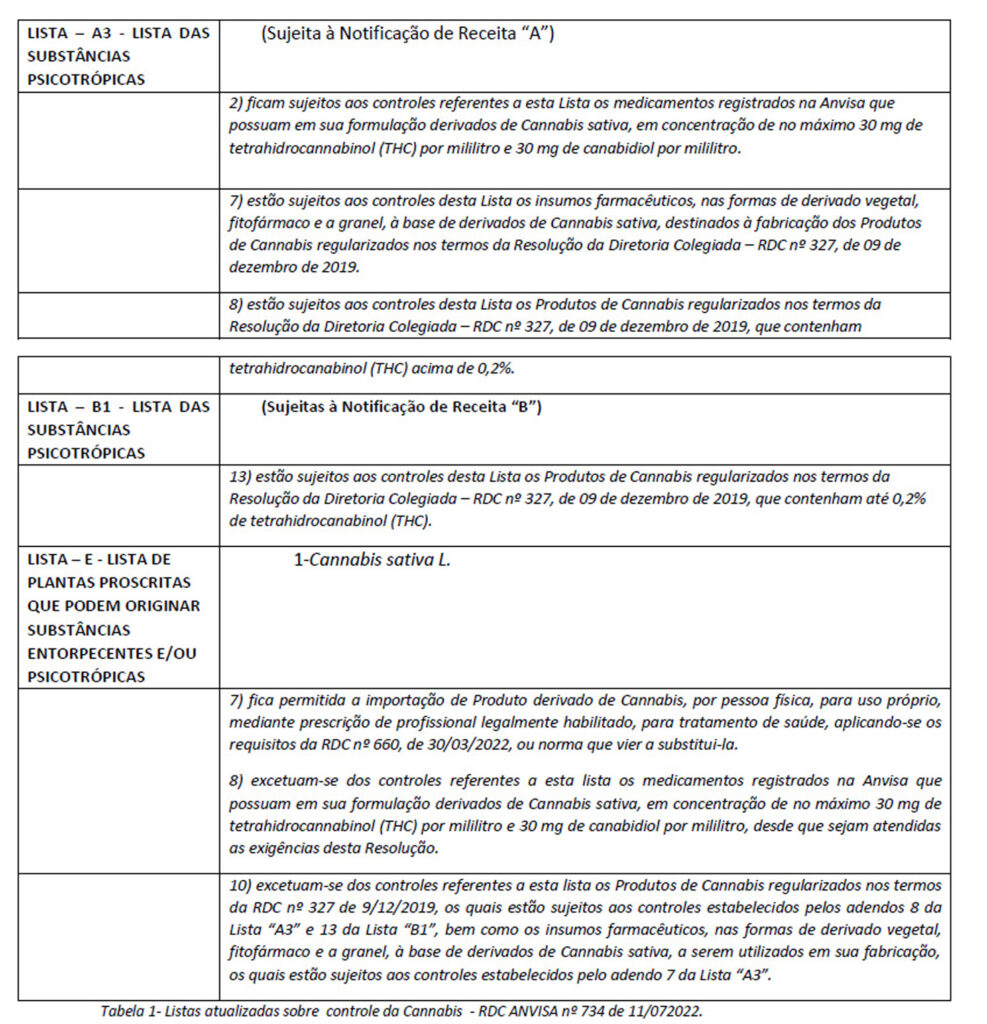
O CFM – Conselho Federal de Medicina – decidiu dar início à abertura para a Cannabis de uso medicinal no Brasil. Mas, com o passar dos anos, se tornou mais restritiva, proibindo a aplicação do tratamento em crianças e adolescentes com epilepsias e refratárias aos tratamentos convencionais.
Recentemente, para ampliar a garantia do acesso, o CFM publicou uma Consulta Pública, encerrada em 30.07.2022, para atualizar a Resolução 2.113/14. A expectativa é que essa revisão corrija a limitação da prescrição pelos médicos.
Em virtude da pressão exercida por pacientes e parentes a ANVISA passou a autorizar a importação de produtos à base de Canabidiol em 2015 pela Resolução da Diretoria Colegiada (RDC) nº 17/2015.
A RDC 335/2020, revogou a RDC 17/2015 e trouxe novos critérios e procedimentos de importação de produtos à base de Canabidiol, simplificando o processo e reduzindo de documentos e informações que devem ser fornecidos pelo requerente.
Posteriormente, a RDC nº 66 de 2016 permitiu a excepcionalidade de importação de produtos com CBD ou THC, atendidos os requisitos nela estabelecidos.
Atualmente os critérios para importação de produto de Cannabis para uso individual é RDC 660/2022, que consolidou as disposições da RDC 335/2020 e RDC 570/2021. A venda nas Farmácias foi viabilizada pela RDC 327/2019, tornando possível que empresas nacionais fabriquem, importem produtos acabados e comercializem os produtos, mediante concessão de autorização sanitária3. A aquisição em farmácias só ocorre sob prescrição médica, retendo a receita (azul ou amarela)¹º
5- Mercado
Segundo a consultoria BDSA, o mercado legal no ano de 2020 atingiu o valor de US$ 21,3 bilhões, com um aumento de quase 50% em relação a 2019, e tem previsão de atingir US$ 55 bilhões em 20263.
Relatório da Whitney Economics informa que o mercado da cannabis no Estados Unidos emprega atualmente cerca de 321 mil pessoas, 77 mil a mais que o ano de 20203.
Segundo a Consultoria Legislativa da Câmara dos Deputados em 2016, o Brasil poderia arrecadar até R$ 5,6 bilhões em tributos num cenário de legalização irrestrita apenas com o uso recreativo3.
Possibilidades de geração de riquezas no Mercado Brasileiro
Podemos inferir que existem expectativas para ampliar o mercado. Vejamos algumas:
➢ Autorizar a plantação da cannabis em território nacional (dotadas de segurança para impedir extravio e desvios) para fins medicinais, o que certamente traria benefícios aos país, como ampliação do agronegócio e toda sua cadeia de suprimentos;
➢ Novos estudos científicos e novas tecnologias de medicamentos pela indústria;
➢ Aumento da produção nacional e redução dos preços finais aos consumidores;
➢ Arrecadação de tributos e geração de empregos;
➢ Redução de custos e ampliação de tratamento médico a pacientes que hoje necessitam da cannabis.
➢ Possibilidade de exportação de produtos acabados, devido à expertise brasileira na produção de medicamentos e à adequada base regulatória.
➢ Ampliação para outras classes de produto: cosméticos, alimentos, veterinários, papel, roupas.
Comercialização
O mercado da cannabis medicinal está expandindo os tratamentos, um deles específico para pets. No Canadá e EUA a diversidade de produtos é grande, que abrange os cosméticos, suplementos alimentares, alimentos, produtos para saúde e vestuário. As possibilidades de utilização da Cannabis são muitas.
De acordo com o Guia SECHAT6, América Latina e Caribe movimentaram US$ 168 milhões em 2020, em termos de CBD. Os dados de crescimento desse segmento são animadores.
A Prohibition Partners estima um mercado global de Cannabis legal de US$ 103,9 bilhões até 2024. Na análise, a América Latina aparece em quarto lugar no ranking de maiores mercados mundiais potenciais, com uma participação de 8,76%6.
A participação dos territórios é projetada da seguinte forma: Europa, com US$ 39,1 bilhões; América do Norte com US$ 37,9 bilhões; Ásia, com US$ 12,5 bilhões; América Latina, com US$ 9,1 bilhões; Oceania, com US$ 2,7 bilhões e África, com US$ 2,6 bilhões.
Ainda na mesma projeção global, em percentuais por segmento, o mercado medicinal ficaria com a participação de 60,35% das vendas, o que representaria US$ 62,7 bilhões. O segmento de uso adulto da cannabis ficaria com 39,65% do mercado, o que representaria US$ 41,2 bilhões.
Segundo relatório da SECHAT6, a New Frontier12 estima que até 2023 o mercado de cannabis medicinal no Brasil atinja o valor de R$ 4,7 bilhões.
Atualmente, os EUA lideram globalmente no faturamento legal da cannabis. Segundo a consultoria especializada BDSA, em 2020, o país norte-americano ficou com 82,16% do volume mundial do faturamento, atingindo vendas de US$ 17,5 bilhões. Segundo projeções o setor emprega cerca de 340 mil pessoas na produção, transporte e comercialização, e arrecadou em impostos, US$ 5 bilhões em 2019. O Canadá, segundo a BDSA, teve crescimento de 61% no mercado legal de cannabis em 2020, 12,2% do faturamento global e registrou US$ 2,6 bilhões em vendas6.
6 – Usos e concentrações permitidas
A definição do teor dos produtos à base de cannabis estão na RDC nº 327/201913 e seu artigo 4º diz:
Os produtos contendo como ativos exclusivamente derivados vegetais ou fitofármacos da Cannabis sativa, devem possuir predominantemente, canabidiol (CBD) e não mais que 0,2% de tetrahidrocanabinol (THC). Poderão conter teor de THC acima de 0,2%, desde que sejam destinados a cuidados paliativos exclusivamente para pacientes sem outras alternativas terapêuticas e em situações clínicas irreversíveis ou terminais.
Conforme o artigo 10, os produtos estão autorizados apenas por via oral ou nasal, sem adição de substâncias isoladas, sintéticas ou semissintéticas. Além disso, os produtos de Cannabis não podem ser de liberação modificada, nanotecnológicos e peguilhados.
7- Fabricação e controle: o que é permitido e o que é vedado
Fabricação
O artigo 10, parágrafo 5º da RDC nº 327/2019, proíbe produção de produtos não medicinais, como: cosméticos, produtos fumígeros, produtos para a saúde ou alimentos à base de Cannabis spp. e derivados13.
Conforme já mencionamos, o Brasil tem uma grande oportunidade para aumentar o número de empregos e a arrecadação de impostos, exportar produtos manufaturados e criar riqueza. Para tanto, pode adotar uma legislação que permita o plantio controlado da planta (hoje proibido) e que permita a extração do óleo de Cannabis para a produção. Sabemos que a produção é permitida desde que se importe o extrato, o fitofármaco ou o produto acabado. Tudo isso encarece o produto para o consumidor e o país deixaria de remeter divisas quando, de fato, poderia estar recebendo divisas.
Plantio
O processo começa com a perfeita seleção de sementes e seu aperfeiçoamento genético ao longo do tempo, para que possa ser obtida uma planta mais resistente e que produza mais.
O adequado plantio deve ser em área que receba quantidade de sol e água, em solo sem contaminantes metálicos e agrotóxicos e colheita das flores na época certa, com rastreabilidade do tipo de planta, para possibilitar localizar isso no lote das flores e do produto. Essa rastreabilidade é importante para manter o histórico e conhecer a qualidade da planta.
Em seguida realiza-se a secagem das flores e a correta armazenagem, identificando o lote e o rastreamento do plantio a que pertence, data de colheita e peso da embalagem. Nessa primeira fase do processo a droga vegetal vai gerar o extrato. Por isso a identificação de lote e data é crucial para manter a rastreabilidade.
Extração
O processo produtivo começa com a extração do óleo das flores de Cannabis. É um processo relativamente simples, semelhante aos processos de obtenção de extratos vegetais de outras plantas. Os equipamentos básicos de produção compõem-se de um extrator, onde a droga vegetal é mergulhada em um solvente por determinado tempo e sob agitação e um destilador, para eliminação do solvente e obtenção do extrato. O líquido resultante da evaporação e aquecimento é o extrato final, também chamado de óleo de Cannabis. Nesta fase pode ocorrer a descarboxilação dos canabinóides, na qual são convertidos de formas ácidas para formas descarboxiladas (por ex.: CBD-A C22H30O4 CBD C21H30O2), por meio da ação da luz e temperatura, principalmente. O extrato obtido deve ser padronizado, determinando as concentrações de THC e CBD.Neste artigo não consideramos a obtenção de outros canabinóides, que possuem ações também importantes, como Canabigerol (CBG), Canabinol (CBN), Canabicromeno (CBC) e Olivetol.
Produção e Envase
Para o produto final, normalmente se utiliza equipamento de mistura de aço inox com camisa de aquecimento e resfriamento, no qual o extrato é disperso em um veículo oleoso ou agente emulsificante de uso farmacêutico e um agente estabilizante da solução. A filtração pode ser utilizada. Temperatura e tempos de mistura devem ser fixados e registrados em Instrução de Fabricação ou equivalente.
Controles em processo e aqueles relativos às Boas Práticas de Fabricação devem ser seguidos: validação do processo produtivo, de limpeza e de metodologias analíticas, qualificação de equipamentos, entre outros.
Padronizar o extrato é requisito de Boas Práticas Farmacêuticas. Para atingir a concentração desejada, o produto final deve ser dosado de novo, garantindo que cada mililitro contenha a dose adequada do produto.
Terminada esta etapa, procede-se ao envase, principalmente em frascos de vidro âmbar e conta gotas de vidro ou gotejador no frasco, tampa com lacre e rótulo. Cartucho com lacre de segurança é desejável.
O produto final é encaminhado ao almoxarifado para armazenagem e despacho. O acesso a essa área deve ser restrito, com controle biométrico, senhas ou formulário manual.
Como é produto controlado pela Portaria nº 344/199810, é necessário controlar o estoque através de inventários cíclicos (entradas, saídas, perdas, amostras) desde o início:
1- Quantidade da droga vegetal obtida na colheita (flores) em peso;
2- Quantidade de extrato obtido em relação à droga vegetal (flores) utilizada;
3- Quantidade de extrato usado na manipulação do produto final;
4- Quantidade de produto final envasado obtido.
5- Quantidade de produtos vendidos.
As análises de controle de qualidade para flores, extrato e produto final seguem a FB- Farmacopeia Brasileira ou outra farmacopeia aprovada pela ANVISA. Devem ser observadas as resoluções da ANVISA – RDC nº 26, de 13 de maio de 2014 e a RDC nº 24, de 14 de junho de 2011 (registro de medicamentos específicos).
Controle de Qualidade da Droga Vegetal (flores)
No caso da Cannabis, o termo Droga vegetal refere-se às flores, que darão origem ao extrato que, por sua vez, originará o produto final. Processos mais refinados levam à obtenção do princípio ativo isolado, pureza quase 100%, chamado de fitofármaco ou IFAV – insumo farmacêutico ativo fitoterápico.
As fases de obtenção da Droga vegetal, do Derivado Vegetal e do Produto acabado necessitam de controle de qualidade com as devidas especificações, capacitação de equipes e controles.
A subseção I da Resolução RDC nº 26, de 13 de maio de 2014, em seu artigo 13, diz:
“Deve ser apresentado laudo de análise da droga vegetal, indicando o método utilizado, especificação e resultados obtidos para um lote dos ensaios abaixo descritos…….”.
e) determinação de metais pesados; f) determinação de resíduos de agrotóxicos e afins;
h) determinação de contaminantes microbiológicos; i) determinação de micotoxinas,
………………………………………………………………………………..
Além destes, outros testes importantes são listados para o registro do fitoterápico.
Para análise rotineira das flores, a Farmacopeia Alemã – DAB 20184 – preconiza que os parâmetros de testes para a droga vegetal (flores) são: Aparência, Matéria Estranha, Tenuidade, Propriedades Microscópicas, TLC, Contaminação microbiológica, Aflatoxinas, Pesticidas, Metais Pesados, Perda por secagem, Ensaio e Substâncias Relacionadas.
Controle de Qualidade do Derivado Vegetal (extrato)
Os testes de rotina da produção sugeridos ao extrato, mas não se limitando a eles, são:
Aparência, Cor, Odor, Identificação de CBD e THC por HPLC, Teor de CBD e THC por HPLC, Bactérias Totais aeróbias, Fungos Totais, Umidade e Densidade8.
Tais testes são importantes para garantir a qualidade do extrato que originará o produto final. O uso de matéria prima adequada mantém a qualidade no produto acabado.
O artigo 15 da Resolução RDC nº 26, de 13 de maio de 2014, diz que:
(…) para registro de fitoterápico, quando a empresa fabricante do fitoterápico utilizar derivados vegetais no seu processo de fabricação, deve ser apresentado laudo de análise, indicando o método utilizado, especificação e resultados obtidos para um lote dos ensaios abaixo descritos, entre outros:
I – solventes e excipientes utilizados na extração do derivado;
II – relação aproximada droga vegetal: derivado vegetal;
a) determinação de metais pesados;
b) determinação de resíduos de agrotóxicos e afins;
c) determinação de resíduos de solventes (para extratos que não sejam obtidos com etanol e/ou água);
e) determinação de micotoxinas, a ser realizada quando citados, em documentação técnico-científica, a necessidade dessa avaliação ou relatos da contaminação da espécie por micotoxinas;
Nota: outros testes complementam a lista disposta nesta resolução mencionada acima.
Controle de Qualidade do Fitofármaco (Insumo ativo fitoterápico isolado)
Em face da inexistência de Monografia do fitofármaco Canabidiol na FB, utilizamos os mesmos conceitos presentes na Resolução RDC nº 654, de 24 de março de 2022, que dispõe sobre as Boas Práticas de Fabricação de Insumos Farmacêuticos Ativos e a Resolução RDC nº 359, de 27 de março de 2020, que Institui o Dossiê de Insumo Farmacêutico Ativo (DIFA) e a Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (CADIFA, para registro de Insumos Farmacêuticos Ativos.
Art. 11. O Dossiê de Insumo Farmacêutico Ativo (DIFA) deve atender, no que for pertinente, às diretrizes dos seguintes guias do ICH e seus documentos complementares:
I – ICH Q1A – Estudos de Estabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
II – ICH Q1B – Estudos de Estabilidade: Estudos de Fotoestabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
III – ICH Q1D – Agrupamento e Matrização para Estudos de Estabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
IV – ICH Q1E – Avaliação de Resultados de Estabilidade;
V – ICH Q2(R1) – Validação de Procedimentos Analíticos;
VI – ICH Q3A(R2) – Impurezas em Novos Insumos Farmacêuticos Ativos;
VII – ICH Q3C(R6) – Impurezas: Guia para Solventes Residuais;
VIII – ICH Q3D(R1) – Guia para Impurezas Elementares, nos termos do ANEXO I desta Resolução;
IX – ICH Q6A – Testes e Critérios de Aceitação para Novos Insumos Farmacêuticos e Novos Medicamentos: Substâncias Químicas;
X – ICH Q11 – Desenvolvimento e Fabricação de Insumos Farmacêuticos Ativos (Entidades Químicas e Entidades Biotecnológicas/Biológicas); e
XI – ICH M7(R1) – Avaliação e Controle de Impurezas Reativas a DNA (Mutagênicas) em Medicamentos para Limitar Risco Carcinogênico Potencial.
Art. 14, 15, 16, 18. Devem ser apresentados Denominação Comum Brasileira (DCB) ou Denominação Comum Internacional (INN), nome químico, número de registro CAS, nome compendial e fórmula estrutural, com configuração estereoquímica, fórmula molecular e massa molecular relativa. Relação de propriedades físico-químicas e outras propriedades que afetam a eficácia e segurança do medicamento, como solubilidade, pKa, polimorfismo, isomerismo, coeficiente de partição (logP), permeabilidade e higroscopicidade. Diagrama da rota de síntese ou processo de obtenção do IFA.
Verificando os testes e informações técnicas solicitados no DIFA/CADIFA, é sensato utilizar, como sugestão, no controle de qualidade de rotina, estes testes: Determinação do teor, Identificação do fármaco, Umidade, Impurezas e pH, dentre os mais críticos, devem fazer parte da rotina de análise do fármaco isolado.
Controle do Produto Acabado
Quando não especificado em Farmacopeia Brasileira ou farmacopeias estrangeiras permitidas, os testes recomendados a serem executados lote a lote, são:
Teor de água, Densidade, Índice de Saponificação (quando usado óleo fixo como excipiente), Índice de Acidez (quando usado óleo fixo como excipiente), Metais pesados, Resíduos de agrotóxicos, teor em Canabidiol, Teor em THC, Outros Canabinóides, Microbiologia
*O controle adequado das MPs e extrato: estes testes podem usar os resultados da Droga vegetal, com base em Análise de Riscos adequada ao processo como um todo, desde o plantio até a produção.
8- Terceirização
Controle de Qualidade
A Empresa Contratante deve qualificar a Empresa Contratada e avaliar a sua competência no atendimento de requisitos de boas práticas laboratoriais por meio de:
I – habilitação junto à Rede Brasileira de Laboratórios Analíticos em Saúde (REBLAS) para os ensaios contratados;
II – disposições da Resolução RDC n° 11, de 16 de fevereiro de 2012 e suas posteriores atualizações;
III – Certificação de Boas Práticas de Fabricação, quando se tratar de empresa fabricante de medicamentos ou produtos biológicos;
IV – acreditação de acordo com a norma ISO 17025 para os ensaios contratados; ou
V – comprovação do cumprimento das Boas Práticas de Laboratório, conforme diretrizes reconhecidas internacionalmente.
A aprovação final para liberação do produto cabe à empresa Contratante.
Importante notar o que diz o artigo Art. 4° da RDC 268/ 201911:
É permitida a contratação parcial ou total dos serviços de terceiros para a realização dos ensaios de controle qualidade para os seguintes medicamentos:
I – dinamizados; II – específicos, que contenham insumo farmacêutico ativo de origem animal ou vegetal ou III – fitoterápicos.
Nosso entendimento é que o controle de qualidade dos produtos de cannabis (um fitoterápico) pode ser realizado em laboratórios terceirizados contratados.
Laboratório de Controle da Qualidade e local de armazenamento das importadoras
O artigo 7º da RDC nº 268/201911 diz: Todas as importadoras devem possuir laboratório de controle de qualidade e local de armazenamento próprios, incluindo local específico para armazenamento de amostras de referência. Além do disposto no caput deste artigo, a empresa deve possuir capacidade técnica e operacional para realizar as atividades necessárias, ou contratar os serviços de terceiros, conforme legislação específica.
Art. 8º O laboratório próprio da importadora situado em território nacional é responsável pela realização de ensaios completos de controle de qualidade, em conformidade com o registro do medicamento na Anvisa, para cada carga recebida, lote a lote.
Estes dois artigos devem ser interpretados juntamente com o artigo 4º acima. Fica claro que a empresa pode terceirizar controle de qualidade do produto, em sua totalidade ou parcialmente. Por outro lado, a empresa deve possuir espaço próprio para armazenagem dos produtos e das amostras de retenção.
9- Movimentos Legislativos para regular o uso da Cannabis
O caminho político em 2022 é importante para o Brasil regular o uso da cannabis medicinal. Na ANVISA teremos a revisão da RDC 327/2019. A consulta pública deve ser disponibilizada em outubro de 2022.
Existe uma possibilidade de haver polarização política durante a revisão da RDC 327/19 e no Congresso Nacional, na discussão sobre o PL nº 399/2015 – Câmara dos Deputados e do PL 5295/19 -Senado Federal7.
É importante registrar que no Congresso Nacional estão em discussão: o PL 399/2015, os PL 7187/2014, PLS 514/2017, PL 5295/2019, PL 4776/2019 e PLS 5158/2019 que de uma ou outra maneira, regulamentam o plantio, o cultivo, comercialização e distribuição da Canabis para fins medicinais7 .
A aprovação, pela Câmara dos Deputados, do Projeto de Lei (PL) nº 399/2015, que passou por uma tramitação especial, propõe alterar o artigo 2º da Lei de Drogas, justamente para viabilizar o plantio, fabricação e a comercialização de medicamentos que contenham extratos, substratos ou partes da planta cannabis sativa em sua formulação7.
O esforço dos Estados e Municípios, que estão buscando customizar disposições que atendam às necessidades dos pacientes dos seus territórios, por meio de Leis e Programas.

Tabela 2 – Resumo do cenário atual sobre as propostas de legislações
O movimento legislativo representa uma grande oportunidade de negócios em um mercado promissor e milionário, como a criação de empregos nas fases do processo de produção, distribuição e comercialização e criar riquezas, exportando manufaturados. Possíveis avanços na lei e ampliações para outras classes de produtos (cosméticos, produtos para saúde, alimentos, têxteis, suplementos e alimentos) tornarão este mercado muito atraente para empresas de diversos segmentos.
10- Considerações finais
Os importantes e diretos reflexos sociais, determinam que o caminho para o uso da Cannabis para fins medicinais, seja por via do legislativo, regulatória ou judicial, não têm mais volta.
É inegável os diversos benefícios obtidos por pacientes portadores do Transtorno do Espectro Autista, da Epilepsia Refratária, da Doença de Parkinson, de Dores Crônicas e de Insônia sinalizados na literatura.
Assim, não há como deixar de reconhecer que essa opção farmacológica, devidamente regulada e validada cientificamente, que deve fazer parte do arsenal terapêutico na medicina brasileira.
Regulamentos e normas que impõem a legalidade e os critérios regulatórios são necessários para a gestão do risco que está intimamente relacionada ao estabelecimento das Boas Práticas de Segurança, necessárias para proteção à saúde. A segurança jurídica é um fator preponderante para trazer ao mercado farmacêutico da Cannabis o amparo aos marcos normativos da ANVISA e ao setor regulado. Além disso, disciplina a fabricação, estabelece as bases para o controle de qualidade e para a farmacovigilância, tudo no sentido de garantir a segurança do paciente. Neste contexto, é necessário que seja entendida a indiscutível relevância para a concretização, sem morosidade e preconceitos, da garantia desse Direito aos pacientes.
Referências
1-ELISALDO ARAÚJO CARLINI. A história da maconha no Brasil. The history of marihuana in Brazil. Disponível em: https://www.scielo.br/j/jbpsiq/a/xGmGR6mBsCFjVMxtHjdsZpC/?lang=pt.
2-ONU E A CANNABIS: as mudanças depois da reclassificação. 07/07/2021. Disponível em: https://thegreenhub.com.br/onu-e-a-cannabis-as-mudancas-depois-da-reclassificacao/. Acessado em: ago/2022.
3-PAULO DANIEL CICOLIN. A pauta legal do uso medicinal da cannabis no Brasil em 2022, 6/10/2021. Disponível em https://www.conjur.com.br/2021-out-06/cicolin-pauta-uso-medicinal-cannabis-brasil-2022.Acessado: 14/09/2022.
4-FARMACOPEIA ALEMÃ – DAB 2018. Cannabisblüten Cannabis flos.
5-FARMACOPEIA ALEMÃ – DAB 2014. Analytical Monograph Cannabis Flos Version 7.1 / November 28, 2014.
6-GUIA SECHAT: SAÚDE E NEGÓCIOS DA CANNABIS. Edição 1, 2021. Disponível em: www.sechat.com.br. Acessado em 01/09/2022.
7-AGÊNCIA SENADO. Cannabis medicinal: realidade à espera de regulamentação. Nelson Oliveira. Publicado: 6/8/2021. Disponível: https://www12.senado.leg.br/noticias/infomaterias/2021/07/cannabis-medicinal-realidade-a-espera-de-regulamentacao. Acessado em 01/08/2022.
8-INSTITUTO FEDERAL DE MEDICAMENTOS E DISPOSITIVOS MÉDICOS ESCRITÓRIO DA COMISSÃO DE FARMACOPEIA. Projeto de Monografia de Extrato de Cannabis. RESULTADOS da 62ª reunião do Comitê de Biologia Farmacêutica da Comissão de Farmacopeia Alemã em 27 de setembro de 2019 – Bonn.
9-BRASIL. ANVISA. Resolução da Diretoria Colegiada – RDC nº 234, de 20 de junho de 2018. Terceirização de etapas de produção, de análises de controle de qualidade, de transporte e de armazenamento de medicamentos e produtos biológicos.
10-BRASIL. Ministério da Saúde. PORTARIA/SVS Nº 344, de 12 de maio de 1998 e suas atualizações. Aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial.
11-ANVISA. Resolução da Diretoria Colegiada – RDC nº 268, de 25 de fevereiro de 2019. Dispõe sobre alteração da Resolução da Diretoria Colegiada – RDC nº 234, de 21 de junho de 2018.
12-NEW FRONTIER DATA. Disponível em: https://newfrontierdata.com/ Acessado em: 01/09/2022.
13-ANVISA. RDC nº 327, de 9/12/2019. Procedimentos para a concessão da Autorização Sanitária para a fabricação e a importação. Estabelece requisitos para a comercialização, prescrição, a dispensação, o monitoramento e a fiscalização de produtos de Cannabis para fins medicinais.
14-CARLINI, Elisaldo. Maconha (Cannabis Sativa): da “erva de diabo” a medicamento, ed. Ciência e Cultura. 1980.
15-ZUARDI, Antonio Waldo. History of Cannabis as a medicine: a review. Revista Brasileira de Psiquiatria, vol. 28, SP, 2005.
*Autores:
Maria José Delgado Fagundes
Advogada especialista em Saúde Pública, Direito Privado, Bioética e Healthcare Compliance, com 34 anos no mercado. Atualmente é founder e CEO da MJDFAGUNDES – Consultoria Especializada em Saúde.
Jair Calixto
Farmacêutico, especialista em Boas Práticas de Fabricação, mais de 50 anos de experiência no setor farmacêutico. Atualmente é assessor/consultor para assuntos ligados às áreas técnicas da Indústria Farmacêutica.
Acesse o artigo completo em: https://www.blogger.com/blog/post/edit/8580069326084249800/4949120096263618042
 2A+ Farma Portal de notícias
2A+ Farma Portal de notícias
