Por Jair Calixto*
Na parte 1 deste artigo abordamos os principais pontos novos no Capítulo II – Sistema da Qualidade Farmacêutica.
Dando continuidade, nesta parte 2, vamos falar do Capítulo IV – Instalações e Equipamentos. Pulamos o Capítulo III, pois os requisitos são os mesmos de normas anteriores, portanto, bem conhecidos e não necessita abordagem agora.
Artigos 64 a 70 do Capítulo IV
O projeto das áreas produtivas deve permitir limpeza e manutenção efetiva, com a finalidade de evitar a contaminação cruzada, o acúmulo de pó ou sujeira que prejudique os produtos. As instalações devem proteger o processo de fabricação, não causar riscos de qualquer contaminação de materiais ou produtos. Questões de limpeza, manutenção, iluminação, temperatura, umidade e ventilação, proteção contra insetos e fluxo de circulação devem ser adequadas e plenamente atendidas. Isto tudo não é novidade, é bem entendido, portanto, sem comentários.
O artigo 70 veda a utilização de quaisquer uma das áreas como passagem/acesso às demais áreas (também citadas pelo mesmo artigo).
Entendo que pessoas de outras áreas não podem circular por lá, de modo a atingir outra área. Porém, os técnicos de uma área que necessitem ir a uma outra, por motivo inerente à sua atividade, como buscar uma amostra, é obvio que é permitido.
O objetivo deste artigo é que os riscos de contaminação cruzada (por meio de transferência mecânica e mistura) sejam mitigados e até mesmo eliminados.
Segundo o P&R, ANVISA informa que, tecnicamente, o acesso à área de CQ via área de produção / embalagem não é aceito. Empresas nesta situação devem promover as devidas adequações.
Artigo 71 do Capítulo IV .
Aqui, começam as exigências para utilização do gerenciamento de riscos, no artigo 71.
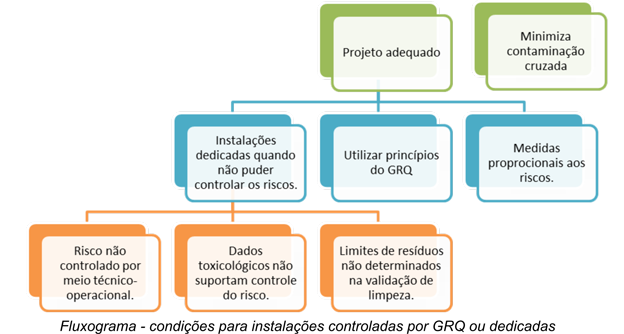
Deve ser utilizado um projeto adequado das instalações para controlar a contaminação cruzada, com facilidade para limpeza, que evite a contaminação ao mínimo e seja facilmente identificável e medida. As vias em que ela ocorre podem ser identificadas através de misturas, retenção das partículas, transferência pelo ar e transferência mecânica.
Dois pontos são importantes para sua minimização:
(1) As medidas devem ser proporcionais aos riscos existentes.
Ou seja, quanto maior o potencial de risco, mais detalhes serão aplicados, mais empenho usado para defini-lo e classificá-lo e mais atenção serão necessários para sua Determinação, Controle e Revisão.
(2) Utilização dos princípios do GRQ para avaliar e controlar os riscos.
As ferramentas do ICH Q9 são as indicadas para esta determinação. Lembro que a identificação do risco é a etapa mais crítica e trabalhosa a ser feita. Tem que haver uma maneira científica de determinar os riscos. Do contrário, será uma tarefa de adivinhação e isto não nos interessa.
De acordo com o nível de risco, deve-se pensar em dedicar as instalações produtivas, pois às vezes, ele é tão difícil de ser controlado ou possui um grau tão elevado, que não compensa elaborar medidas técnicas ou operacionais para sua contenção ou os dados toxicológicos não suportam as medidas técnicas e operacionais ou os limites residuais não podem ser controlados na validação de limpeza.
Às vezes, o próprio produto, em si, não permite o gerencimento por meio da avaliação de riscos. Por exemplo os beta-lactâmicos, dado o seu potencial alergênico não permitem que se faça o gerenciamento dos riscos, sendo melhor dedicar as instalações. Então, quando não puder controlar os riscos, a opção é instalação dedicada. O fluxograma abaixo mostra visualmente o artigo 71.
Dentro deste escopo, cabe a explicação sobre a interpretação para material com potencial alergênico do P&R da ANVISA: A interpretação atual da Agência limita-se aos beta-lactâmicos. Entretanto, cabe a cada empresa, como conhecedora absoluta de seus produtos e processos, encaixar outros fármacos nesta classe caso entenda como necessário durante o gerenciamento dos riscos envolvidos. O compartilhamento depende da capacidade de a empresa realizar o gerenciamento de risco…….. < e continua …..>.
Ressalte-se que a norma não veda o compartilhamento permitido pela IN nº 2/2015. Porém, para os produtos veterinários, continua valendo o entendimento de que o compartilhamento é possível para produtos que contenham exclusivamente insumos cuja segurança para uso humano já tenha sido demonstrada e aprovada.
Demais artigos do Capítulo IV: artigos 72 a 84. A produção deve ser feita em áreas interligadas (através de uma ordem lógica), na sequência das operações e com os níveis de limpeza requeridos. O fluxo das operações sempre foi importante e este requisito de BPF já constava nos textos das resoluções mais antigas.
As áreas de produção devem ser efetivamente ventiladas, com ar apropriado aos produtos manipulados, incluindo temperatura, umidade e filtração, às operações realizadas e ao ambiente externo. Nenhuma novidade, mas os artigos enfatizam o controle do ambiente, assim como medidas para evitar misturas e a contaminação cruzada.
Os controles em processo podem ser executados na área de produção, desde que não representem nenhum risco para esta atividade. Na RDC 17/2010 isto não estava inserido. É uma sinalização para abordagem ao PAT.
Bem, continuarei com a análise no próximo artigo, analisando o Capítulo V- Documentação.
Jair Calixto é especialista em Boas Práticas de Fabricação do IBBPF. Visite o Canal BPF no YouTube e o Instagram.
 2A+ Farma Portal de notícias
2A+ Farma Portal de notícias

